心脏离子通道病诊疗指南
概述
由于心肌细胞离子通道功能障碍而导致的一大类疾病称为离子通道病(cardiac ion channelopathies,CICP)。CICP可分为遗传性和获得性两大类。遗传性CICP是由心脏特定的基因缺陷而导致的疾病,如长QT综合征(long QT syndrome,LQTS)、短QT综合征(short QT syndrome,SQTS)、Brugada综合征(Brugada syndrome,BrS)、儿茶酚胺敏感型多形性室性心动过速(catecholaminergic polymorphic ventricular tachycardia,CPVT)等。该类疾病能引起多种恶性心律失常,最终导致患者晕厥、心脏骤停,甚至心源性猝死。现主要介绍遗传性离子通道病。
病因和流行病学
LQTS发病率估测为1/2500例活产婴儿。SQTS极为罕见,主要影响青壮年或婴儿,具体发病率不详。由于BrS患者异常心电图表现往往是间歇性的,并有明显的区域性,很难估计患病率,欧洲和美国的患病率较低,为1/10 000~1/3300。欧洲国家CPVT的患病率为1/10 000。
LQTS中已有13种突变基因被发现,依次对应KCNQ1、KCNH2、SCN5A、ANK2、KCNE1、KCNE2、KCNJ2、CACNA1C、CAV3、SCN4B、AKAP9、SNTA1和KCNJ5。其中KCNQ1(LQT1)、KCNH2(LQT2)及SCN5A(LQT3)为常见的致病基因,约占遗传性LQTS基因检测确诊患者的92%。中国LQTS发病群体中,以LQT2型最为常见。
短的QT间期反映了心肌细胞跨膜离子流的紊乱,表现为心肌细胞动作电位和有效不应期缩短。在内、外各种理化因素的作用下,心肌兴奋性增加,离散度增大,复极不均匀,较易出现折返激动和多种类型心律失常。目前已经发现SQTS的7种基因型,KCNH2(SQTS1),KCNQ1(SQTS2),KCNJ2(SQTS3),CACNA1C(SQTS4),CACNB2b(SQTS5),CACNA2D1(SQTS6)和SCN5A(SQTS7)。
BrS主要是一种由SCN5A钠离子通道基因突变引起的常染色体显性遗传病。发生机制是动作电位0期钠电流的减弱,使得一过性外向钾电流(Ito)电流明显增大,从而引起动作电位时程缩短;心室肌细胞内、中、外三层存在离子通道表达差异,其电生理特性各异,当各种理化因素引起心外膜细胞动作电位明显缩短时,心外膜心内膜之间跨膜电位差增大,易出现二相折返性心律失常。目前认为与BrS相关的基因有SCN5A(BrS1)、GPD1-L(BrS2)、CACNA1C(BrS3)、CACNB2b(BrS4)、SCN1B(BrS5)、KCNE3(BrS6)、SCN3B(BrS7)和KCNJ8(BrS8)。
CPVT发生心律失常的基础可能是心肌细胞钙紊乱及钙超载诱发的动作电位晚期后除极(DADs)。目前发现与CPVT有关的突变基因有RyR2(CPVT1)、CASQ2(CPVT2)、CALM1(CPVT3)、TRDN(CPVT4)和KCNJ2(CPVT5)。RyR2是编码调控心脏钙稳态蛋白之一,调控心肌细胞动作电位中钙触发的钙释放,其基因突变占据临床诊断的CPVT患者的55%~60%。
临床表现
LQTS包括以下几种类型:Romano-Ward综合征(RWS)、Jervell-Lange-Nielsen综合征(JLNS)及Timothy综合征。RWS为常染色体显性遗传,其中1~3亚型占97%,临床多见,发病率约为1/2000。主要表现为QT延长和晕厥或者致死性心律失常。LQT 1和2型常在劳累、运动和情绪紧张时发作,LQT 3型常在睡眠时发作。JLNS伴内耳感音神经性听力下降,为常染色体隐性遗传疾病,比RWS更少见。
Timothy综合征为长QT综合征8型,致病基因CACNA1C,患病率非常低,迄今为止全世界仅报道25例,是一种罕见的多器官障碍的遗传性疾病。其主要临床表现为LQT综合征,合并指/趾畸形,先天性心脏病、异常面容、神经系统疾病或孤独症。对LQTS发病特征简要总结如下:
发病年龄小,女性多见。
常有晕厥或猝死家族史。
不同基因型和表现型,可累及钾、钠、钙通道。常有特征性尖端扭转性室速(TdP),导致晕厥或猝死。
ECG表现为QT间期延长。
心电图一般有如下特征:①表现为QT间期延长,短-长-短周期现象诱发;②心室率160~240bpm,QRS波振幅与形态围绕等电位线扭转,5~20个心动周期主波围绕基线扭转一次,多数能自行终止;③ATP较难终止TdP。
SQTS患者首次发病可早至出生后第1年、晚至80岁。SQTS患者临床表现取决于并发心律失常的种类及伴随其他系统功能异常。其发病特点主要有:
- ①好发于年轻人,心脏检查常无器质性疾病,血液生化检查正常;
- ②可无症状或表现为心悸、头晕,重者晕厥、猝死,易合并房颤;
- ③ECG表现为QT间期明显缩短,T波多高尖;
- ④室性心律失常多表现为室颤(VF)。
Brugada综合征具有明显的遗传异质性和家族遗传倾向,为常染色体显性遗传病。临床疾病谱较宽,有无症状基因携带者和反复晕厥及猝死者,其中约60%有家族史。其临床特点主要有:
- ①中青年多发,40岁为高峰,男性患者多见,亚洲人群高发;
- ②患者心脏结构正常;
- ③窦性心律时ECG示右束支传导阻滞(RBBB),V1~V3导联ST段抬高;
- ④室性心律失常多为多形性室速或VF,可导致晕厥或猝死。部分室性心律失常可自行终止,ATP较难终止此类心律失常。
CPVT多数患者在10~20岁出现症状,3岁以前发病的患者非常罕见。临床发病特点:
- ①无器质性心脏病的儿童、青少年多发。临床上以运动或情绪激动引起的双向、多形性室速,晕厥和猝死为主要特征。
- ②不能解释的运动或儿茶酚胺诱发双向室速或多形性室性早搏(VPB)或室速(VT)。
- ③运动试验或滴注肾上腺素可诱发室性心律失常。
- ④其典型心电图特点为:双向性室速,额面导联QRS电轴逐级轮替180°变换;随着运动负荷的增加,室性心律失常越来越复杂:单个室性期前收缩(PVC)-室早二联律→非持续性VT→持续性VT→VF。
辅助检查
实验室检查 一般实验室化验指标并无特殊提示。可以明确有无电解质异常、心肌损害等。
心电图和动态心电图 心电图会显示以上疾病的异常表现(QT间期、ST-T等)。动态心电图有可能会发现室性心律失常。
运动心电图 通过运动负荷有可能诱发心电的异常。
影像学 超声心动图和心脏核磁检查未发现有心脏结构的异常。
基因检测 阳性结果有助于临床诊断。
诊断
目前多采用Schwartz评分系统进行LQTS的诊断,包括心电图、临床病史和家族3个部分。
心电图表现(排除了可能导致的药物或疾病) (1)QTc≥480毫秒:3分;460~470毫秒:2分;450~459毫秒(男性):1分; (2)运动负荷试验结束后第4分钟QTc≥480毫秒:1分; (3)尖端扭转型室性心动过速:2分; (4)T波交替(TWA):1分; (5)3个导联存在T波切迹:1分; (6)静息心率低于相应年龄的第2百分位数(仅限于儿童):0.5分。
临床病史 (1)晕厥(TdP和晕厥中只能选1项计分):应激引起:2分,非应激引起:1分; (2)先天性耳聋:0.5分。
家族史(同一家族成员满足下列两项标准时,不累积计分) (1)家族成员中有患LQTS者:1分; (2)一级亲属在30岁以前有不明原因的心脏性猝死:0.5分。 两项表现相加最终评分:≤1分为低概率,1.5~3分为中等概率,≥3.5分为高概率。
SQT诊断有相应评分标准(修订的Gollob标准):
心电图 QTc<370毫秒:1分;<350毫秒:2分;<330毫秒:3分;J点-T波峰间期<120毫秒:1分。
临床病史(心电图表现至少有1分时才能进行该项评分) 心脏骤停病史:2分;有记录的多形性室速或者室颤:2分;原因不明晕厥:1分;房颤:1分。
家族史(心电图表现至少有1分时才能进行该项评分) 一级或者二级亲属SQTS可能性极大:2分;一级或者二级亲属尸检阴性的心源性猝死:1分;婴儿猝死综合征家族史:1分。
基因检测(心电图表现至少有1分时才能进行该项评分) 阳性:2分;罪犯基因中意义不明的突变:1分。≥4分高度可能;3分中度可能;≤2分低度可能。
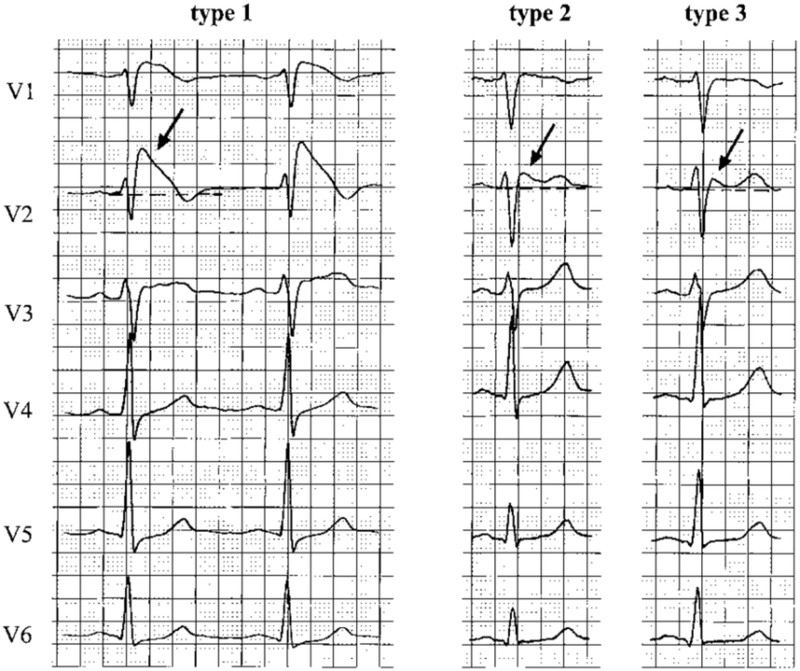
Brs诊断标准可简单归纳为1+1/5的诊断方式:1是指患者有自发性或诱发的1型Brugada波;1/5是指患者另需满足以下5个条件中的一个。Ⅰ型Brugada波型指心电图上ST段穹窿样抬高≥2mm,J点抬高伴T波倒置,ST-T形态为下斜形;必要时可以通过提高右胸导联心电图的记录位置和药物激发来获得典型的1型Brugada波(图1)。5个条件包括:①患者本人有心室颤动、多形性室速;②患者本人有晕厥或夜间濒死呼吸;③患者本人电生理检查可诱发室颤、室速;④家族成员有45岁以下猝死者;⑤家族成员有1型Brugada 波。
CPVT诊断依据:
- ①心律失常的发生与肾上腺素分泌增多(运动或情绪激动)有关;
- ②心律失常发生时表现为典型的双向性室速,而在休息时心电图无明显异常;
- ③心脏结构正常。
诊断方法:
- ①运动试验,在CPVT患者运动能诱发心律失常,故可用于诊断、调整药物剂量和监测病情;
- ②药物激发试验,去甲肾上腺素或肾上腺素激发试验有助于临床诊断,有文献报道肾上腺素激发试验的阳性率高于运动试验;
- ③其他,动态心电图、植入式环形记录器等长程检测有助于检出CPVT。
鉴别诊断
LQT需要与药物或其他疾病所致的QT间期延长相鉴别。SQT则应排除其他可能导致QT间期缩短的原因,包括正常变异、高钾血症、酸中毒、高钙血症、过热、洋地黄类药物的作用、乙酰胆碱或儿茶酚胺的作用等。Brs则需要排除其他可以导致类似心电图表现的疾病,例如早期复极综合征、致心律失常右室心肌病、急性心包炎、急性心肌缺血或心肌梗死、变异型心绞痛、急性脑卒中、中枢或自主神经系统异常、肺栓塞、主动脉夹层、维生素B1缺乏、高钾血症、高钙血症、漏斗胸、低体温症、纵隔肿瘤或心包积血压迫右室流出道等。CPVT需要与LQT、致心律失常性右心室心肌病和Andersen Tawil综合征相鉴别。洋地黄中毒也可以引起双相室性心动过速。
治疗
主要为生活方式调整、药物治疗、器械治疗和其他治疗。对遗传性心脏离子通道病进行危险分层,风险评估,可帮助临床医师制定正确的临床决策。长QT综合征危险分层因素包括QTc长短、T波电交替及存在2个致病基因变异等;Brs危险分层因素主要有基因变异及碎裂QRS波;CPVT危险分层因素包含心脏骤停病史、发病年龄及是否使用β受体拮抗剂。携带KCNQ1基因突变的SQTS更易发生心律失常,或需积极的预防治疗措施。
生活方式调整 包括避免激烈的体育活动或者过度劳累。LQTS1患者应避免剧烈运动,尤其是游泳,所有的LQTS患者均应避免使用延长QT间期或者降低血钾的药物,如Ⅰa和Ⅲ类抗心律失常药物,如奎尼丁、丙吡胺、胺碘酮,大环内酯类和喹诺酮类抗生素、非镇静抗组胺药、三环类抗抑郁药和精神科用药等。避免减肥、腹泻等因饮食或代谢失衡造成的电解质紊乱(低钾、低镁、低血钙等)。CPVT患者应避免运动、应激和强烈的情感刺激。
药物治疗 除非有禁忌证, 否则对有症状的QT间期肯定延长的LQTS患者应该给予β受体阻滞剂。首选普萘洛尔,不能坚持可用纳多洛尔、长效美托洛尔、卡维地洛、阿罗洛尔,避免使用短效美托洛尔。据临床研究,普萘洛尔比纳多洛尔和美托洛尔显著缩短QTc;美托洛尔的无事件生存时间显著短于普萘洛尔和纳多洛尔;美托洛尔应用期间心脏事件增加。对于所有伴自发性或者明确应激诱导CPVT患者,也推荐使用β受体拮抗剂治疗。对于拒绝植入ICD、存在植入ICD的绝对禁忌证或植入ICD会产生问题的极年轻患者以及因复发性室性心律失常导致ICD频繁放电的SQT患者,推荐使用可延长QT间期的药物奎尼丁。同样,对于不适合植入(婴幼儿患者)或者不能、拒绝植入ICD的Brs患者,也可以考虑奎尼丁治疗。对于β受体拮抗剂治疗后仍然发生室性心律失常、晕厥的CPVT患者,可考虑使用维拉帕米,同时合并或不合并使用β受体拮抗剂。
植入型自动心律转复除颤器(AICD) 用于心脏停搏复苏者、合理β受体阻滞剂治疗中仍持续昏厥者以及β受体阻滞剂禁忌的LQT和CPVT患者。AICD也是唯一有效预防SQTS和Brs患者猝死的治疗方法。
其他 对于上述治疗方法无效或病情仍进展迅速的LQT和CPVT患者,可以考虑切除左侧高位胸交感神经节。然而其能否实现稳定的长程抗心律失常作用,尚有待大规模临床研究证实。
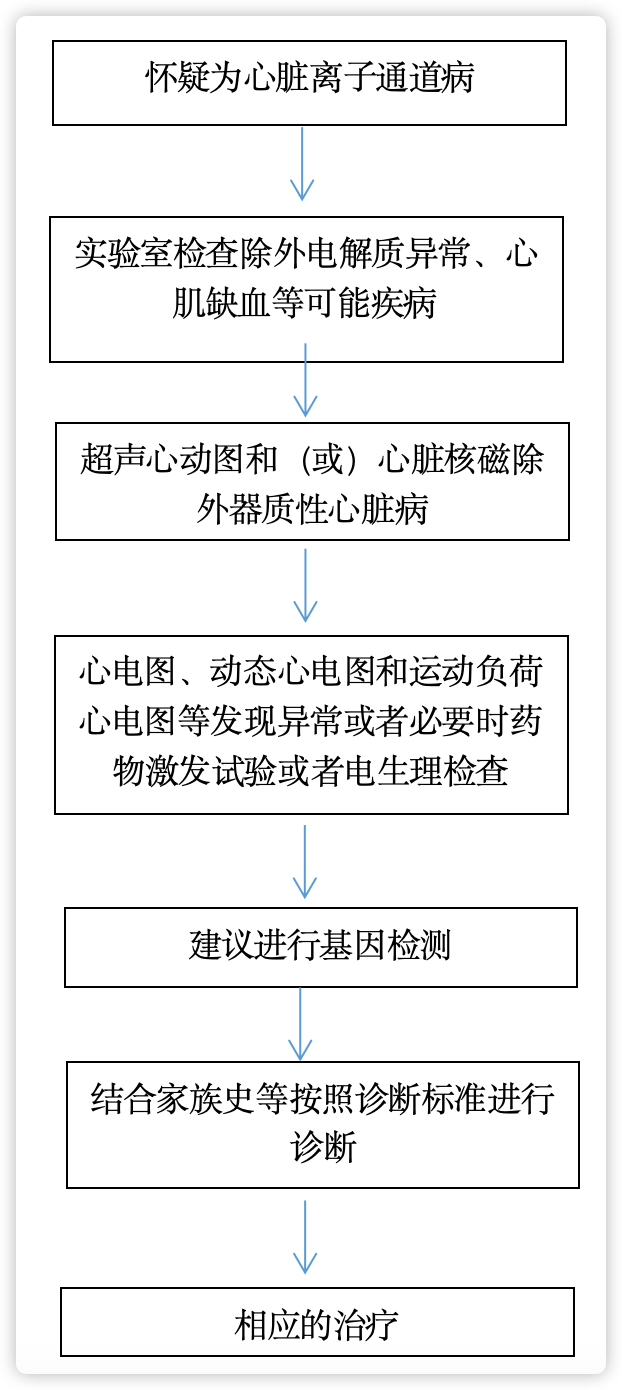
诊疗流程(图2)
参考文献
[1] Moss AJ. Long QT Syndrome. JAMA, 2003, 289(16):2041-2044.
[2] Aekerman MJ,Priori SG,Willems S,et al.HRS/EHRA expert consensus statement on the state of genetic testing for the channelopathies and cardiomyopathies:this document was developed as a partnership between the Heart Rhythm Society(HRS) and the European Heart Rhythm Association(EHRA). Europace, 2011,13(8):1077-1109.
[3] Brenyo AJ, Huang DT, Aktas MK. Congenital long and short QT syndrome. Cardiology, 2012, 122(4):237-247.
[4] Priori SG, Wilde AA, Horie M, et al. HRS/EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes: document endorsed by HRS, EHRA, and APHRS in May 2013 and by ACCF, AHA, PACES, and AEPC in June 2013. Heart Rhythm, 2013, 10(12):1932-1963.
[5] Brugada R, Campuzano O, Sarquella-Brugada G, et al. Brugada syndrome. Methodist Debakey Cardiovasc J, 2014, 10(1):25-28.
[6] Broendberg AK, Nielsen JC, Bjerre J, et al. Nationwide experience of catecholaminergic polymorphic ventricular tachycardia caused by RyR2 mutations. Heart, 2017, 103(12): 901-909.
上一篇: 自身免疫性垂体炎诊疗指南
下一篇: 溶血性尿毒症综合征诊疗指南